在新一期“巢上的力量工作坊”中,新生巢了邀请了来自Certara的李改玲博士和宁佳博士两位嘉宾,开启了科盛达系列讲座的第一讲:Journey on Translation Science to Medicine。其中,李改玲博士结合自身30年的创新药临床开发经验,做了《药企如何避开死亡之谷,在竞争中生存并保持领先》的主题分享。宁佳博士主要介绍了PBPK模型如何助力加速药物发现和药物申报。从两位博士的分享
中,我们撷取部分内容,以飨读者。欲获取更多详情,欢迎大家继续关注科盛达系列讲座,参与现场的交流互动。
创新药早期生存的三大支柱
3 Pillars of Survivors
在创新药研发的早期阶段,把握好三大要素,可以有效提升研发的成功率。首先,靶部位暴露量(Drug exposure at the site of action),在靶点部位的药物暴露,是发挥药效的物质基础。其次,药物需要和药理学靶标相结合(Binding to the pharmacological target);再次,靶部位药理学作用发挥(Expression of pharmacological activity)。
结合这3个要素可以建立一个坐标轴,横轴为药理学维度,纵轴为暴露维度,由此得到4个象限,如下图。
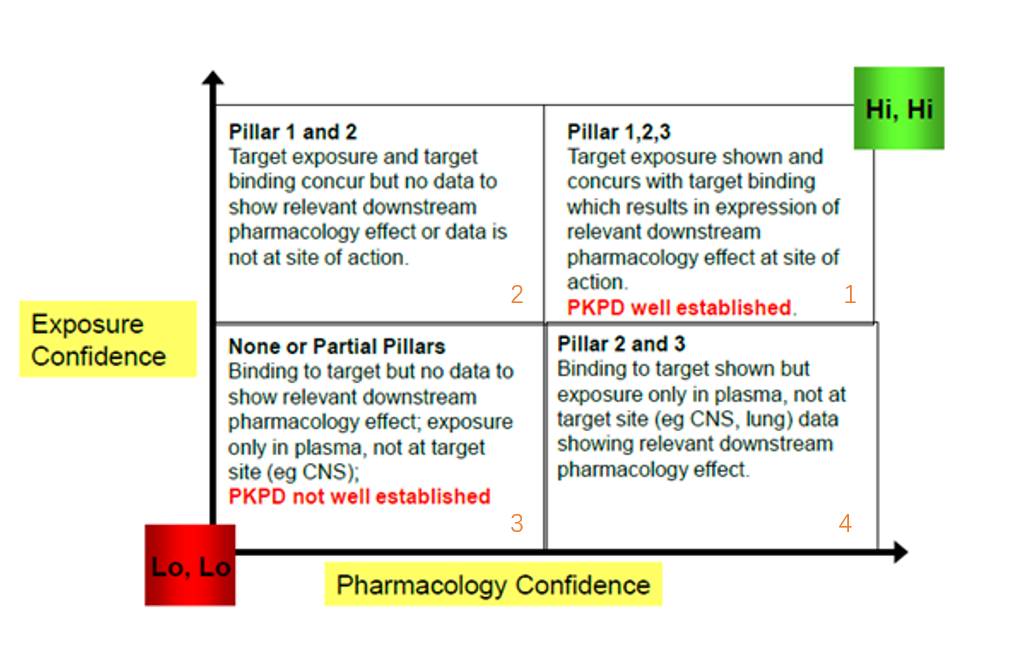
(Paul. Morgan, Piet H. Van der Graaf et als, Drug Discovery Today, Volume 17, Issues 9–10, 2012, 419 - 424)
符合第一象限特点的项目满足所有3个条件,可以重点推进,与之相反,处于第三象限的项目风险会高很多。第二和第四象限的项目则要充分考量三缺一的情况下,对于缺少的“一”所引入的风险有多大。实际上,Pfizer回顾了其44多个项目,套用该原则,大部分符合第一象限特点项目成功进入Ⅲ期,其余象限项目则很少启动Ⅲ期研究,说明这一标准对于评估项目是否应该从Ⅱ期推进到Ⅲ期是合适的。
2010年的时候,Pfizer的研发成功率(From FIH to approval)是落后于行业平均水平的,2% vs 5%。而到2020年的时候,Pfizer的这一数字已经达到21%,提高了10倍,也远超11%的行业平均水平,其原因就是辉瑞严格遵循了创新药早期生存的三大支柱的原则:3 Pillars of survival 及时砍掉了不符合原则的管线,从而提高了研发成功率。
这个小小的四象限工具体现出新药研发理论和实践的完美契合。药企可以充分运用此类工具,定期检查药物研发进展,一旦出现质疑,要停下来反思靶点、通路和药物这三个方面是否存在问题,尽早做决定,及时止损,避免烧钱烧时间。
后期研发的失败原因分析
在药物研发上,绝对完美主义约等于失败的代名词。药物研发过程中,需要考虑的因素和变量非常多,例如靶点选择、化学物筛选,CMC合成及其稳定性,药物的吸收、分布、代谢、排泄、安全性和毒理等问题,成本要素,知识产权保护……跨越多个学科和部门。在这些维度上,基本上每个方向都要做出妥协,才能产生最终成药的药物。
靶点选择不当是新药研发失败的常见原因之一。当临床知识或科学进展还不足以支撑我们对某个靶点具备完善的认知时,有一种比较常规的做法是,拿病人和健康人的数据做对比分析,找出其中存在差异的蛋白或者DNA等元素。但是,这种方法存在一个致命缺陷:搞不清该差异到底是疾病的后果还是诱因。在因果关系尚不明确的情况下,有些药企就急不可耐地想要冲锋陷阵,几个化学家、生物学家坐一块,拿着paper商量商量就开干,很可能找了一个结果当抓手来设计临床药物,导致从第一天开始,就决然踏上一条不归路。
医药研发史上曾有一个非常典型的例子。大家都知道,降低低密度脂蛋白胆固醇可以降低冠状动脉粥样硬化的风险,当低密度脂蛋白降低以后,高密度脂蛋白一般会出现提升。于是就有人突发奇想,找一款提升高密度脂蛋白的药物是不是能解决心脏问题?一时间众多药企蜂拥而上,纷纷推进 CPETP(Targeting the Cholesterol Ester Transfer Protein)研发,期待HDL-C 提升后会显著降低冠状动脉粥样硬化风险,结果做完多达一万五千例受试者的大规模临床试验后,遭遇全线滑铁卢。这也提醒我们,在药物研发过程中,应多关注靶点和通路对于疾病治疗是否有驱动性的效果。
如果说早期研发像一道探索题,那么,临床三期的成功更像是做一道证明题——证明药物的疗效不差于对照药或者现有的治疗药物,甚至优于它们。三期失败有多重原因,其中有一些问题是可以规避的,例如剂量、患者人群的选择、control variability的元素等等。但往往因为前期工作的不充分,导致这些问题没有得到应有的重视。
临床三期失败的另一个常见的原因,是在二期实验设计中,过分追求优效的结果,对病人的挑选过于精心刻意,以至于不能充分反映现实世界的情况,于是到了三期实验,当病人数量急剧上升时,原本优效的结果瞬间稀释得荡然无存,给企业造成巨大的损失。
如何更好地提升出海审批成功率
当创新药出海,遭遇FDA拒绝而不幸折戟沉沙时,有些人下意识的第一反应,是不是FDA对来自中国的产品有偏见,对中国地区的数据不接受?但是,看待问题不能如此简单的非黑即白,固守某种刻板印象,只会加深彼此的误解,对解决问题无济于事。
举个例子,Fotivda是来自欧洲的AVEO Oncology公司开发的一款新药,在EMA获批之后,2013年进军美国,遭遇FDA一口拒绝,其原因就在于其三期实验中,88%的病人数据来自于欧洲,只有8%病人数据来自美国本土受试者,而且黑人数据只有1例。稍加换位思考就能想明白,对药监部门而言,确保本国病人的用药风险获益可控,正是其职责所在。市场博弈中,利他和利己,一个不能少。所以对国内药企来说,不管国内病人的数据有多漂亮,如果做好了出海的打算,就尽可能提前布局海外病人的数据获取,增强数据的说服力。
此外,还有一个老生常谈的问题,就是对照药的使用。众所周知,创新药的研发周期很长,很可能药企早期研发时选择的竞品药物,到了三期对照,已经跟当下最能表现的临床实验结果相脱节。
实际上,创新药出海过程中,应当视当地监管为合作伙伴,积极主动地与其沟通交流,尽可能就药物的临床开发思路和关键环节达成一致。